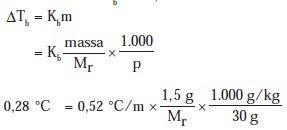Seperti halnya pada kenaikan titik didih adanya zat terlarut dalam larutan menyebabkan titik beku larutan lebih kecil daripada titik beku pelarutnya. Hal ini disebabkan oleh terjadinya penguapan pada seluruh bagian zat cair.
Contoh Soal Dan Pembahasan Sifat Koligatif Larutan Elektrolit
Contoh soal kenaikan titik didih. Berlawanan dengan penurunan titik beku larutan kenaikan titik didih larutan merupakan fenomena meningkatkan titik didih suatu pelarut disebabkan adanya zat terlarut didalam pelarut tersebut. Kenaikan titik didih yang disebabkan oleh satu mol zat yang dilarutkan dalam 1000 gram zat pelarut mempunyai harga yang tetap dan disebut tetapan kenaikan titik didih molal kb. Di bidang thermodinamika konstanta titik beku pelarut kb lebih dikenal dengan istilah konstanta ebulioskopik. Contoh soal sifat koligatif larutan kenaikan titik didih. Oleh dosenpendidikan diposting pada 02072020. Contoh soal kenaikan titik didih.
Tentukan titik didih dan titik beku larutan berikut. Contoh soal sifat koligatif larutan kenaikan titik didih dan penurunan titik beku adalah sebagai berikut. δtb kenaikan titik didih kb tetapan kenaikan titik didih molal δtf penurunan titik beku. Hitung titik didih larutan tersebut. Penurunan titik beku δt f f berasal dari kata freeze berbanding lurus dengan molalitas m larutan. Titik didih zat cair dapat diukur dengan tekanan 1 atmosfer.
Natrium hidroksida 16 gram dilarutkan dalam 500 gram air. K b air 052 0 cm ar na 23 ar o 16 ar h 1 pembahasan. Glukosa c6h12o6 18 gram dalam 10 gram air. Kenaikan titik didih titik didih zat cair merupakan suhu tetap disaat zat cair mendidih. Urea conh22 30 gram dalam 500 gram air. Pada suhu ini tekanan uap zat cair memiliki persamaan pada tekanan udara yang ada disekitarnya.